پتاسیم دی کرومات
فهرست مطالب

مقدمه
ترکیبات پتاسیم بسیار رایج هستند و برای اهداف مختلف مفید می باشند. از پتاس و سایر ترکیبات پتاسیم قرن ها در ساخت محصولات شیشه ای استفاده می شود. امروزه 95 درصد از ترکیبات پتاسیم جمع آوری شده در جهان در ساخت کود استفاده می شود.
پتاسیم دی کرومات که به عنوان پتاسیم بی کرومات نیز شناخته میشود، یک ترکیب شیمیایی معدنی است که اهمیت صنعتی و آزمایشگاهی زیادی دارد. این ماده یک جامد کریستالی نارنجی با فرمول شیمیایی K2Cr2O7 است. این محصول یک عامل اکسید کننده قوی است و در آب محلول است. در تخمین حجمی نمک های آهن، یدیدها و سولفیدها برای تهیه زاج کروم، زرد کروم و قرمز کروم استفاده میشود. در ادامه این مقاله برای شناخت بیشتر دی کرومات پتاسیم و کابردها و نحوه خرید این ماده با ما همراه باشید.
بی کرومات پتاسیم چیست
یک معرف شیمیایی معدنی با نام شیمیایی پتاسیم دی کرومات که به آن بی کرومات پتاسیم یا بی کرومات دی پتاسیم نیز می گویند. این ماده یک جامد یونی کریستالی، با رنگ قرمز نارنجی روشن است. بی بو و نامحلول در استون و همچنین الکل است اما در آب حل میشود.
به طور گستردهای به عنوان یک پیش ماده برای زاج پتاسیم کروم و دباغی چرم استفاده میشود. معمولاً به عنوان یک عامل اکسید کننده در چندین صنعت و آزمایشگاه استفاده میشود. بسیار خورنده و غیر قابل احتراق است.
| K2Cr2O7 | Potassium dichromate |
| Molecular Weight/ Molar Mass | 294.185 g/mol |
| Density | 2.68 g/cm³ |
| Boiling Point | 500 °C |
| Melting Point | 398 °C |
برخی دیگر از خواص مهم پتاسیم دی کرومات در زیر ذکر شده است.
K2Cr2O7 ظاهری کریستالی و نارنجی متمایل به قرمز دارد.
در دمای 0oC، حلالیت این ترکیب در آب معادل 49 گرم در لیتر است.
این ترکیب در الکل و استون نامحلول است.
ظرفیت گرمایی پتاسیم دی کرومات 219 ژول در هر مول است.
آنتروپی مولی استاندارد این ترکیب 291.2 ژول بر مول کلوین است.
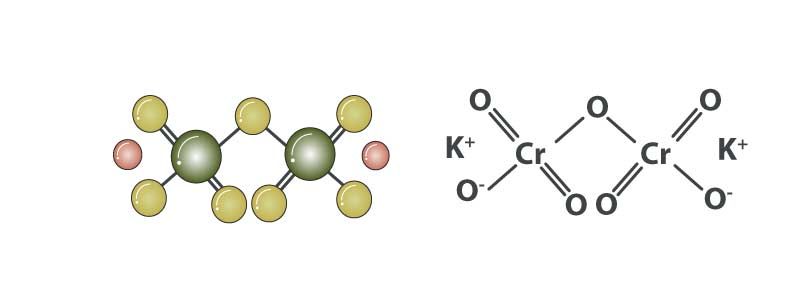
ساختار پتاسیم دی کرومات
مولکولهای پتاسیم دی کرومات دارای دو پیوند یونی بین دو کاتیون پتاسیم با بار مثبت و آنیون دی کرومات است که دارای بار 2- است. یون دی کرومات دارای دو اتم کروم است که به چهار اتم مختلف اکسیژن پیوند دارند. دو تا از این پیوندهای Cr-O پیوندهای دوگانه و یکی از اتم های اکسیژن به هر دو اتم کروم پیوند دارد. آخرین اتمهای اکسیژن که بهصورت مجزا به اتم کروم متصل شدهاند دارای بار 1- هستند (همانطور که در زیر نشان داده شده است).
کاربرد دی کرومات پتاسیم
از کاربرد دی کرومات پتاسیم به عنوان نمونه میتوان به موارد زیر اشاره کرد:
1- در سیمان برای کند کردن گیرش مخلوط و بهبود چگالی آن به همراه بافت استفاده میشود. در چاپ 2- روی صفحه عکاسی استفاده میشود.
3- این ماده یک معرف معمولی است که در شیمی تجزیه برای “آزمایشات مرطوب” کلاسیک استفاده میشود.
4- برای رنگ آمیزی انواع خاصی از چوبها برای ایجاد رنگهای قهوهای عمیق و غنی استفاده میشود.
5- برای تمیز کردن ظروف شیشهای و به عنوان ماده حکاکی استفاده میشود.
6-در نمایشگرهای آتش نشانی همراه با آهن و تنگستن استفاده میشود.
7- از نظر پزشکی میتوان از آن به عنوان ضد عفونی کننده، سوزاننده و قابض به صورت خارجی استفاده کرد.
8- دی کرومات پتاسیم زمانی که در محلول اسید نیتریک تقریباً 35 درصد حل میشود، یک معرف تحلیلی به نام محلول شورتر را تشکیل میدهد. این معرف را میتوان برای آزمایش وجود فلزات مختلف به ویژه برای تعیین خلوص نقره استفاده کرد. نقره خالص محلول را قرمز روشن میکند در حالی که نقره استرلینگ به آن رنگ قرمز تیره میبخشد. علاوه بر این، نقره سکهای با کیفیت پایین این محلول را قهوهای میکند (عمدتا به دلیل وجود مس که محلول را قهوه ای میکند). همچنین میتوان اشاره کرد که 0.500 نقره محلول شورتر را سبز میکند. اگرچه طلا و پالادیوم جابجا نمیشوند، برنج این محلول را به رنگ قهوهای تیره در میآورد در حالی که مس رنگ قهوهای میدهد. در نهایت، فلزات سرب و قلع وقتی به محلول دی کرومات پتاسیم در اسید نیتریک 35 درصد (تقریباً) معرفی میشوند، محلولهای زرد تشکیل میدهند.
واکنش پتاسیم دی کرومات با اسید سولفوریک
دی کرومات پتاسیم (K2Cr2O7) با اسید سولفوریک (H2SO4) واکنش میدهد تا سولفات پتاسیم (K2SO4)، سولفات کروم (Cr2(SO4)3)، آب (H2SO4) و گاز (Ooxy) تولید کند.
معادله شیمیایی :
2 K2Cr2O7 + 8 H2SO4 → 2 K2SO4 + 2 Cr2(SO4)3 + 8 H2O + 3 O2
این یک واکنش کاهش اکسیداسیون است.
کروم موجود در دی کرومات پتاسیم از حالت اکسیداسیون 6+ به 3+ در سولفات کروم کاهش مییابد.
در طی واکنش اکسیژن به صورت گاز آزاد میشود.
توجه: واکنش معمولاً برای شروع نیاز به حرارت دارد.
این واکنش اغلب به عنوان منبع اکسیژن در آزمایشات آزمایشگاهی استفاده میشود.
واکنش پتاسیم دی کرومات با هیدروکلریک اسید
دی کرومات پتاسیم (K2Cr2O7) با اسید هیدروکلریک (HCl) در یک واکنش اکسیداسیون – کاهش واکنش میدهد. محصولات حاصل از واکنش عبارتند از پتاسیم کلراید (KCl)، کلرید کروم (III) (CrCl3)، آب (H2O) و گاز کلر (Cl2).
معادله شیمیایی :
K2Cr2O7 + 14 HCl → 2 KCl + 2 CrCl3 + 7 H2O + 3 Cl2
کروم موجود در دی کرومات پتاسیم از حالت اکسیداسیون 6+ به 3+ در کروم (III) کلرید کاهش مییابد.
کلر موجود در اسید هیدروکلریک از حالت اکسیداسیون 1- تا 0 در گاز کلر اکسید میشود.
گاز کلر یک گاز سمی و تحریک کننده است.
این واکنش معمولاً در شرایط گرمایش انجام میشود.
این واکنش باعث تولید مواد مضر و سمی از جمله گاز کلر و ترکیبات کروم میشود. هنگام انجام این واکنش، اقدامات احتیاطی مناسب باید رعایت شود.
واکنش اگزالیک اسید با پتاسیم دی کرومات
اسید اگزالیک با پتاسیم ذی کرومات در یک محیط اسیدی (معمولاً توسط اسید سولفوریک تهیه میشود) واکنش میدهد تا تحت یک واکنش ردوکس قرار گیرد.
در این واکنش، اسید اگزالیک به دی اکسید کربن اکسید میشود، در حالی که دی کرومات پتاسیم به سولفات کروم (III) احیا میشود.
معادله شیمیایی :
2 K2Cr2O7 + 3 H2C2O4 + 8 H2SO4 → 2 K2SO4 + 2 Cr2(SO4)3 + 6 CO2 + 11 H2O
اکسیداسیون: اسید اگزالیک (C2H2O4) به دی اکسید کربن (CO2) اکسید میشود.
کاهش: پتاسیم دی کرومات (K2Cr2O7) به سولفات کروم (III) (Cr2(SO4)3 احیا میشود.
محیط اسیدی: اسید سولفوریک (H2SO4) محیط اسیدی لازم را برای انجام واکنش فراهم میکند.
این واکنش اغلب در تیتراسیون برای تعیین غلظت محلول اسید اگزالیک یا پتاسیم دی کرومات استفاده میشود.
همچنین به دلیل خاصیت اکسید کننده پتاسیم دی کرومات در فرآیندهای تمیز کردن و پرداخت استفاده میشود.
پتاسیم دی کرومات MSDS
H272: ممکن است آتش را تشدید کند. اکسید کننده
H301: در صورت بلعیده شدن سمی است.
H312: در تماس با پوست مضر است.
H314: باعث سوختگی شدید پوست و آسیب چشم می شود.
H330: در صورت استنشاق کشنده.
H334: در صورت استنشاق ممکن است علائم آلرژی یا آسم یا مشکلات تنفسی ایجاد کند.
H335: ممکن است باعث تحریک تنفسی شود.
H340: ممکن است باعث نقص ژنتیکی شود.
H350: ممکن است باعث سرطان شود.
H360FD: ممکن است به باروری آسیب برساند. ممکن است به کودک متولد نشده آسیب برساند.
H372: در صورت استنشاق، از طریق تماس طولانی مدت یا مکرر باعث آسیب به اندام ها می شود.
H410: برای آبزیان بسیار سمی با اثرات طولانی مدت.
P210: دور از حرارت، سطوح داغ، جرقه، شعله باز و سایر منابع اشتعال نگهداری شود. سیگار کشیدن ممنوع.
P260: گرد و غبار تنفس نکنید.
P280: از دستکش محافظ / لباس محافظ / محافظ چشم / محافظ صورت / محافظ شنوایی استفاده کنید.
P303 + P361 + P353: در صورت قرار گرفتن بر روی پوست (یا مو): بلافاصله تمام لباس های آلوده را درآورید. پوست را با آب بشویید.
P304 + P340 + P310: در صورت استنشاق: فرد را به هوای تازه ببرید و برای تنفس راحت باشید. فوراً با مرکز مسمومیت/پزشک تماس بگیرید.
P305 + P351 + P338: در صورت ورود به چشم: چند دقیقه با احتیاط با آب بشویید. لنزهای تماسی را در صورت وجود و انجام آسان بردارید. به آبکشی ادامه دهید.





منبع
https://byjus.com/chemistry/k2cr2o7/
تهیه و تنظیم: فرهاد سلام زاده



دیدگاه خود را ثبت کنید
تمایل دارید در گفتگو شرکت کنید؟نظری بدهید!